I. Giới thiệu về cấu hình electron
Cấu hình electron là cách sắp xếp các electron trong các phân lớp electron của nguyên tử. Việc nắm vững cách viết cấu hình electron là nền tảng quan trọng để hiểu được tính chất hóa học của các nguyên tố và dự đoán khả năng phản ứng của chúng.
II. Các khái niệm cơ bản
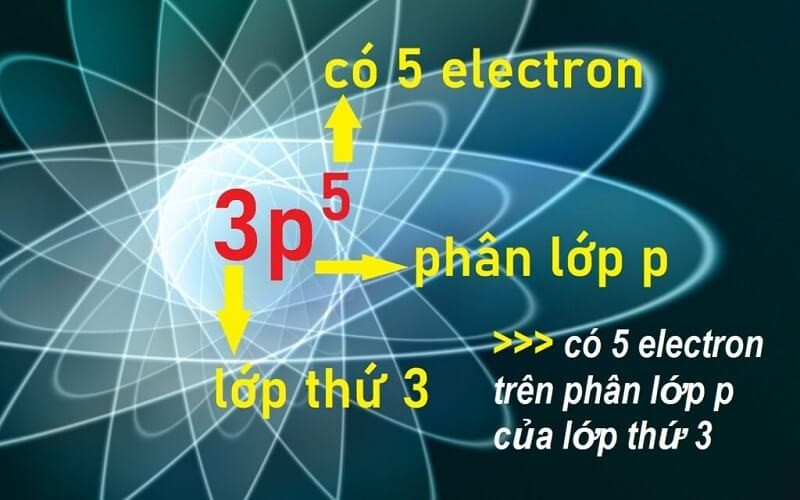
1. Lớp electron (n)
- Các lớp electron được đánh số từ 1 đến 7 (K, L, M, N, O, P, Q)
- Số electron tối đa trong mỗi lớp: 2n²
2. Phân lớp electron
- s: chứa tối đa 2 electron
- p: chứa tối đa 6 electron
- d: chứa tối đa 10 electron
- f: chứa tối đa 14 electron
III. Nguyên tắc viết cấu hình electron
1. Nguyên tắc vững bền
- Electron được sắp xếp sao cho tổng năng lượng thấp nhất
- Các orbital cùng mức năng lượng, mỗi orbital chứa tối đa 2 electron
2. Nguyên tắc Pauli
- Trong một orbital không được phép có 2 electron cùng số quantum
- Mỗi orbital chỉ chứa tối đa 2 electron với spin ngược chiều
3. Quy tắc Hund
- Các electron trong các orbital cùng phân lớp phải được điền đơn lẻ hết trước khi ghép đôi
- Các electron đơn lẻ phải có spin cùng chiều

IV. Thứ tự điền electron
1. Nguyên tắc aufbau
Thứ tự điền electron theo mức năng lượng tăng dần:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p
2. Cách ghi nhớ
- Sử dụng sơ đồ mũi tên
- Quy tắc (n+l): Orbital có tổng (n+l) nhỏ hơn sẽ được điền trước
- Nếu (n+l) bằng nhau, orbital có n nhỏ hơn được điền trước
V. Các trường hợp đặc biệt
1. Cấu hình electron bán bão hòa và bão hòa
- Bán bão hòa: các orbital cùng phân lớp đều có 1 electron
- Bão hòa: các orbital được điền đầy đủ electron
2. Cấu hình electron của ion
- Ion dương: bớt electron từ lớp ngoài cùng
- Ion âm: thêm electron vào lớp ngoài cùng
3. Hiệu ứng bền vững
- d⁵ (bán bão hòa): Cr: [Ar]3d⁵4s¹
- d¹⁰ (bão hòa): Cu: [Ar]3d¹⁰4s¹
VI. Ví dụ minh họa
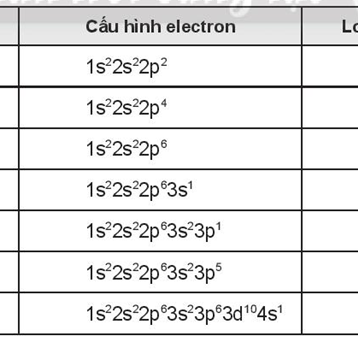
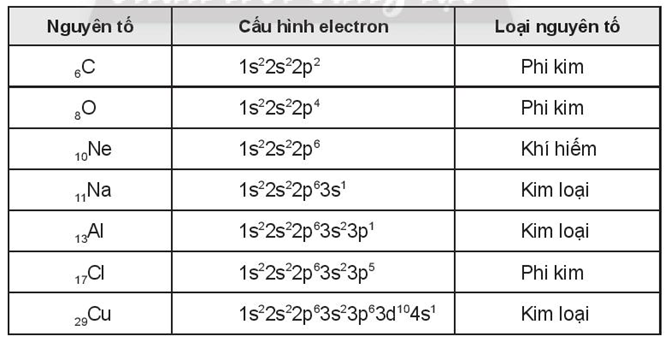
1. Viết cấu hình electron của Natri (Z=11)
Na: 1s² 2s² 2p⁶ 3s¹
hoặc: [Ne]3s¹
2. Viết cấu hình electron của ion Fe²⁺ (Z=26)
Fe: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s²
Fe²⁺: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶
hoặc: [Ar]3d⁶
VII. Bài tập thực hành
Bài tập 1:
Viết cấu hình electron của các nguyên tố sau:
a) Magie (Z=12)
b) Nhôm (Z=13)
c) Photpho (Z=15)
Lời giải:
a) Mg: 1s² 2s² 2p⁶ 3s² hoặc [Ne]3s²
b) Al: 1s² 2s² 2p⁶ 3s² 3p¹ hoặc [Ne]3s² 3p¹
c) P: 1s² 2s² 2p⁶ 3s² 3p³ hoặc [Ne]3s² 3p³
VIII. Mẹo và lời khuyên
- Học thuộc thứ tự các orbital theo nguyên tắc aufbau
- Vẽ sơ đồ mũi tên để dễ nhớ thứ tự điền electron
- Chú ý các trường hợp đặc biệt của các nguyên tố chuyển tiếp
- Thực hành nhiều bài tập để rèn luyện kỹ năng
IX. Ứng dụng trong học tập và nghiên cứu
- Xác định vị trí nguyên tố trong bảng tuần hoàn
- Dự đoán tính chất hóa học của nguyên tố
- Giải thích liên kết hóa học
- Hiểu được cơ chế phản ứng
X. Kết luận
Viết cấu hình electron là một kỹ năng cơ bản nhưng rất quan trọng trong học tập hóa học. Việc nắm vững các nguyên tắc và thực hành thường xuyên sẽ giúp bạn:
- Hiểu sâu về cấu tạo nguyên tử
- Dự đoán được tính chất của các nguyên tố
- Giải quyết tốt các bài tập về cấu hình electron
- Áp dụng kiến thức vào các phần học khác của hóa học
Để được tư vấn và hỗ trợ thêm về môn Hóa học cũng như các môn học khác, vui lòng liên hệ:
Cánh Học Tiếng Anh
- Hotline: 0909 333 000
- Email: [email protected]
- Website: https://cachhoctienganh.net
Cánh Học Tiếng Anh tự hào là đơn vị chia sẻ kiến thức giáo dục uy tín, mang đến cho học sinh những tài liệu học tập chất lượng và phương pháp học hiệu quả.